探索钙调蛋白的多特异性识别的分子机制
bv伟德国际体育博士研究生刘飞在公司唐敖庆讲座教授汪劲教授的指导下,通过分子动力学模拟的方法,提出了钙调蛋白与其靶标在生物分子识别过程中混合的能量地貌景观和机制,并揭示了这种混合机制和钙调蛋白与多种靶标多特异性结合的重要联系。该成果在美国科学院院报Proceedings of the National Academy of Sciences of the United States of America 2017 114 (20) E3927-E3934上发表。
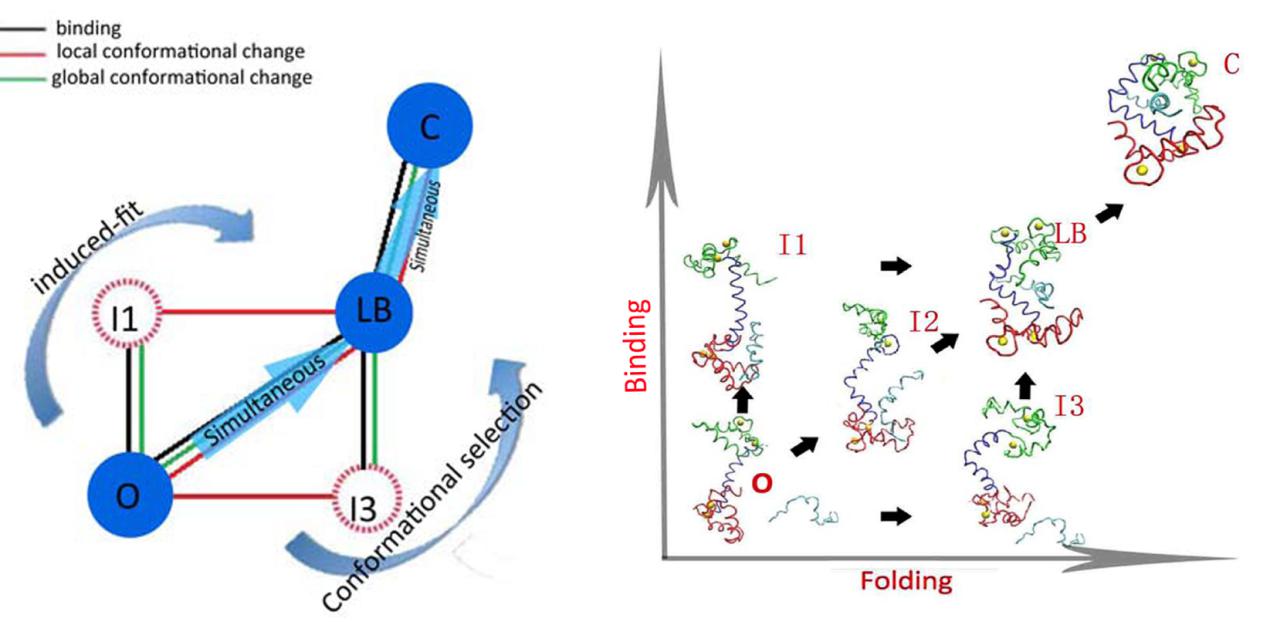
钙调蛋白是一种信号蛋白,它能与300多种靶标结合并把Ca2+离子信号传递到各种生物过程,从而实现基因调控,细胞骨架组织,肌肉收缩,信号转导,代谢调控等多种功能。探索钙调蛋白与多种靶标的多特异性识别的分子机制对理解这些生物过程至关重要。汪劲研究员课题组通过构建介观构象转变模型,用分子动力学的方法研究了同时涉及的钙调蛋白质局部构象变化和结合靶标全局构象变化的结合过程。 对于钙调蛋白和结合靶标的识别过程,他们发现了非典型“诱导拟合”,非典型“构象选择”和“同时结合折叠”的混合能量地貌景观并揭示了这种混合机制和钙调蛋白与多种靶标多特异性结合的重要联系。发现还指出,这种复杂机制是由于分子间各种潜在相互作用和生物分子柔性的协调作用所决定。钙调蛋白经过生物进化而来的天然结构和其靶标特殊的天然结构,会导致其结合过程选择各种不同但最优的结合方案。最终导致了高亲和力和特异性,这无疑使生物分子间多特异性结合的概率大大增加。进而,这项研究为蛋白质与蛋白质多特异性结合这一课题提供了一个全局的量化的物理机制,丰富我们对生物分子相互识别作用的认识。
图像为:非典型“诱导拟合”,非典型“构象选择”和“同时结合折叠”的混合的能量地貌

附件: